

Research
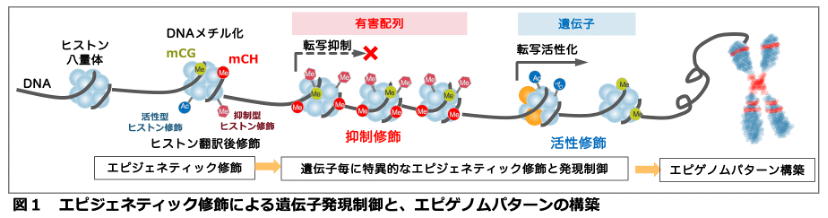
多細胞生物の一個体内の細胞は、基本的に同じDNA配列を持ちます。細胞に固有の形質を発現させるためには、細胞毎に特有の遺伝子を使いわける必要があり、それを可能にするのが「エピジェネティクス」です。エピジェネティクスとは、DNAやヒストンタンパク質に化学修飾を施して、DNA配列の変化を伴わずに遺伝子の活性状態を規定する仕組みです(図1)。その制御の中核は多くの真核生物に保存され、生殖、発生、環境応答など様々なプロセスにおいて重要な役割を果たします。
多くの生物のゲノムDNAには、生命機能に必要な遺伝子だけでなく、転移因子やウィルスなどの潜在的に有害な配列も多量に含まれます。そのため生物は、これらをきちんと見分け、それぞれに適したエピジェネティック修飾を施して、その発現を制御します。この制御機構に異常や破綻が生じれば、発生異常や癌などの疾患を誘発します。それだけ重要であるにもかかわらず、生物がゲノム内の遺伝子と有害配列をどのように見分けるのか? いつ、どの細胞で見分けるのか?外から新しく有害配列が侵入した場合はどうなる?など、今だに多くの謎が未解決のまま残されています。
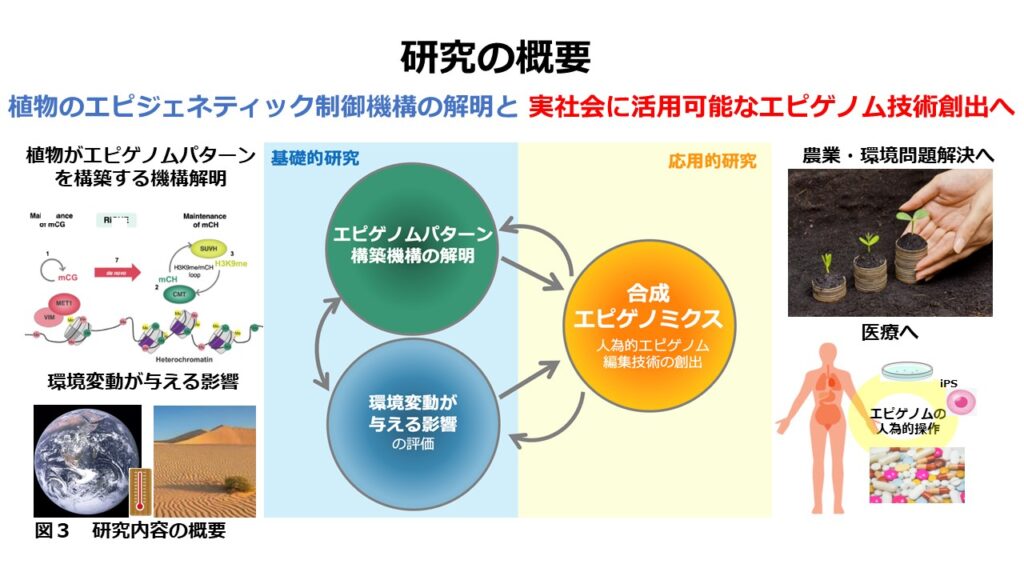
私たちの研究室では、多くの生物学的イベントを司る根幹機構「エピジェネティクス」について、植物や分裂酵母を実験材料に用いて(図2)、基礎と応用の両面から、精力的に研究を展開しています。特に、生物がエピジェネティック修飾を介して遺伝子や有害配列を適切に制御する仕組みや、そうした修飾がどのように次世代へと遺伝するのか、環境変動がエピゲノムパターンに与える影響などを解明しようとしています。
加えて、こうした基礎研究の成果を軸として、人為的エピゲノム編集技術の開発にも挑戦しています。得られた新技術を、モデル生物だけでなく作物や動物細胞にも応用展開し、SDGs達成や医療技術開発にも貢献していくことを目指しています(図3)。
東京工業大学 藤研究室